エントロピーの定義とエントロピー増大の法則の意味
状態Oを基準とする状態Aのエントロピーは以下の式で表す。
: 温度
: 準静的過程で入ってきた熱
エントロピーは示量変数で,記号は で表現される。
※準静的過程:熱平衡状態が保たれている理想的な過程
別の記事で熱力学第二法則(トムソンの原理・クラウジウスの原理)について解説しました。→熱力学第二法則
熱力学第二法則を数式で表現しようとすると,クラウジウスの不等式を導く事ができます。さらに,クラウジウスの不等式から新しい状態量であるエントロピーが定義されます。
エントロピーは状態量でない熱 を状態量のみを用いて表現できることに大きな意味があります。
断熱過程のとき,エントロピーを用いたエントロピー増大の法則は自然界でも重要な法則です。この記事では,エントロピーの導出やエントロピー増大の法則についてわかりやすく解説していきます。
熱力学第二法則とクラウジウスの不等式
熱力学第二法則とクラウジウスの不等式
熱力学第二法則のトムソンの原理「熱源から熱を受け取り,それを全て仕事に変えるような熱サイクルは存在しない。」について数式で表すことを考えます。
まず,任意の熱効率 とカルノーサイクルの熱効率 には次のように表現できます。
カルノーの定理より,2つの式には次のような関係があります。
順サイクル(高熱源から低熱源に熱を放出する過程)では,, を考慮に入れて,カルノーの定理に代入すると,
, より,
となります。可逆サイクルのときに等号が成立し,不可逆サイクルのときは不等号が成立します。
上記の式は熱源が2つの場合の関係式です。この熱源を 個 に増やし,熱源 (各温度 ) について考えます。
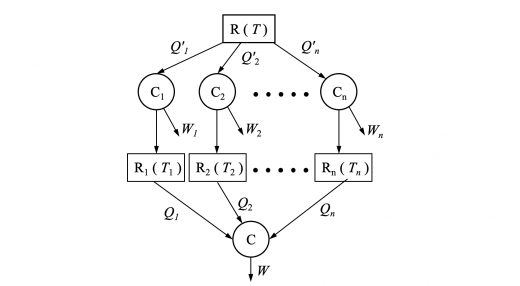
n個の熱サイクルでは,
-
可逆サイクル は温度 の熱源 から熱 を吸収します。
-
可逆サイクル は外部に仕事 をし,残りの熱 を各熱源 に放出します。
-
任意のサイクル は各熱源 から熱 を吸収し,外部に仕事 をします。
任意のサイクル について熱力学第一法則より,
また,各サイクル について熱力学第一法則より,
個の式の辺々を足し合わせると,
となります。
ここで, と を足し合わせた大きなサイクルについて考えます。
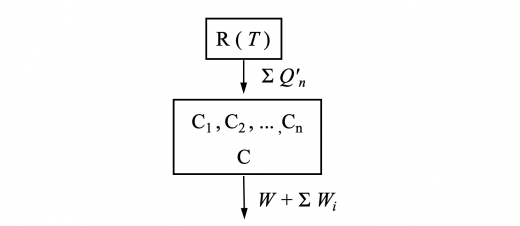
もし, だとすると,熱源 から熱 を受け取り,すべての熱を仕事 に100%変換していることになっています。
これは熱力学第二法則のトムソンの原理「熱源から熱を受け取り,それを全て仕事に変えるような熱サイクルは存在しない。」に反します。
したがって,
でなければいけません。これは外部から仕事した全てを熱として熱源 に戻すことを意味しています。
一方, は可逆サイクルのため,
が成立し, 個の式を考えると,
より,
という式を導くことができます。等号は可逆変化の場合,不等号は不可逆変化の場合で成立します。この式を温度 の微小部分から熱 を吸収すると考え積分系に直すと,
となります。これをクラウジウスの不等式といい,熱力学第二法則を数式化したものと考えられます。積分記号 は1サイクルについて積分することを表しています。
この記事に関連するQ&A
エントロピーの定義
エントロピーの定義
図のようなp-vグラフにおける状態 と状態 に関する状態変化について考えます。過程 と過程 の二種類考えられ,どちらも可逆過程です。
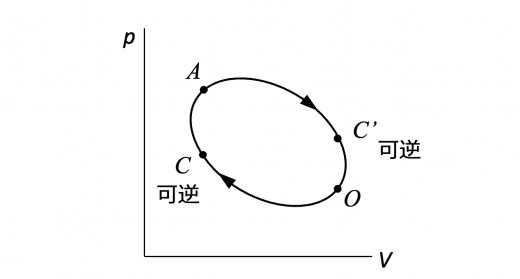
式で表現すると,
となります。過程 と過程 は逆の経路のため,
が成り立ちます。上の式と組み合わせて,
となります。
したがって, は経路に依存せず,状態 と状態 のみで決まるため状態量となります。クラウジウスはこれを新しい状態量としてエントロピーと定義しました。
状態Oを基準とする状態Aのエントロピーは以下の式で表す。
: 温度
: 準静的過程で入ってきた熱
エントロピーは示量変数で,記号は で表現される。
※準静的過程とは熱平衡状態が保たれている理想的な過程
エントロピーの微小変化 は,
となり,
と書き直すことができます。よって,エントロピー を用いることで,非状態量である熱 を状態量を使って表現できるようになりました。エントロピーの単位は で表されます。
さらに,熱力学第一法則はエントロピーを用いて,
と書き直すことも可能です。
エントロピーの記号 について
エントロピーの記号に を用いることに,違和感を覚えた方もいるのではないでしょうか?
記号 は,フランスの物理学者サディ・カルノー(1796-1832)の頭文字にあたります。カルノーは「カルノーサイクル」の研究で熱力学の発展に大きく貢献しています。
ただし,エントロピーを定義したのはドイツの物理学者ルドルフ・クラウジウス(1822-1888)です。
エントロピー増大の法則
エントロピー増大の法則
状態量のエントロピーが持つ物理的な意味は,「エントロピー増大の法則」が示しています。ここではエントロピー増大の法則について解説していきます。

状態Xから状態Yへの不可逆過程(Irrev)と,状態Yから状態Xへの可逆過程(Rev)を考えます。クラウジウスの不等式 について考えると,
となります。不可逆過程を含むので不等号のみ成立します。可逆過程の場合は等号が成立します。エントロピーの微小変化 に関して,
となります。ここで,状態Xから状態Yへ断熱過程の場合を考えると が成立します。
したがって, 不可逆断熱過程ではエントロピーは増大します。可逆過程では等号が成立します。これをエントロピー増大の法則といいます。
断熱過程(孤立系)のとき,
が成り立ち,エントロピーは増加する。
可逆過程のとき等号が成立するため,エントロピーは変化しない。
不可逆変化はエントロピーが増大する方向と一致し,熱平衡状態(安定状態)はエントロピーが最大の状態となります。

宇宙の膨張とエントロピー増大則
余談ですが,宇宙全体を孤立系(断熱系)と考えると,「エントロピー増大の法則」が成り立ち,宇宙のエントロピーは増大し続けます。
理論的には最終的にエントロピーが最大化し,宇宙が熱平衡状態に達します。すると,宇宙の温度が均一化され生命活動が維持できなくなります。この状態は「宇宙の熱的死」といわれています。
エントロピー変化の例題
エントロピー変化に関する例題を解いていきます。
理想気体が断熱膨張する場合のエントロピー変化を求めよ。

この問題を「ピストンを動かし気体を準静的に膨張させながら,温度が低下しないように熱を加えた等温変化過程」と言い換えることができる※。このように考える方がエントロピーは計算しやすい。
等温変化のため温度Tは一定。ピストンに気体がする仕事 は,気体に与える仕事 に等しいため,エントロピー変化は,
となる。()
※この言い換えができるのは,気体は真空中へ膨張するため ,断熱過程のため ,よって内部エネルギー変化 となるため,温度 が変化していないためである。(断熱過程+等積変化)
統計力学とエントロピー
統計力学とエントロピー
エントロピーの概念は熱力学分野から生まれたものですが,エントロピーは統計力学において重要な役割を果たしています。エントロピーの簡単な説明に「エントロピーは"乱雑さ"を示している」というものがあります。
エントロピーが乱雑さと説明されるのは,統計力学的な解釈(確率的解釈)に基づいています。簡単な分子論モデルを使ってエントロピーや不可逆過程について考えていきます。
エントロピー増大則と確率的解釈
気体拡散におけるエントロピー変化についてに考えていきます。
状態Aでは箱を左右で区切り,左側はガス,右側は真空です。仕切りを外すと状態Aから状態Bに変化していきます。
- 状態A:ガスが左側に集まっている状態(仕切りを外した直後)
- 状態B:ガスが箱全体に充満した状態
状態A→状態Bは不可逆変化であることは直感的に理解できると思います。

上記のことを確率的に解釈すると,仕切りを外した直後の状態Aは,めったに起こり得ない特殊な状態です。ガスが自然に一部分に集まることは起きないからです。
一方,状態Bはよく起こりうる状態です。
つまり,上記の不可逆変化は確率が低い状態から,確率が高い状態に遷移することを意味しています。
熱力学において,エントロピーが増加する方向と不可逆変化は一致します。すなわち,統計力学における不可逆変化(エントロピーが増大する方向)は,低確率の状態から高確率の状態への変化といえます。
そして,確率が最大のとき,エントロピーが最大となります。

気体拡散の例から,気体分子が"乱雑"なほどエントロピーが大きく,秩序的なほどエントロピーが小さいともいえます。そのため,エントロピーを乱雑さの指標として解釈することができます。
ボルツマンの関係式の導出
上記の気体拡散の例を状態数を用いて考えてみます。状態AとBの状態数を , とすると,系全体の状態数は積で表現でき, となります。
また,エントロピーは示量変数で加法が成り立ち,状態AとBのエントロピーを , とすると,系全体のエントロピーは と記述できます。
エントロピー は状態数 に依存する関数であり, と との間には対数を用いて,
が成り立ちます。したがって,エントロピー と状態数 に,
という関係が導かれます。これはボルツマンの関係式といいます。この式は状態数とエントロピーを結ぶ重要な式です。 はボルツマン定数()といいます。
熱力学第三法則とエントロピー
熱力学第一法則,熱力学第二法則に続いて,熱力学第三法則も存在します。ネルンストの熱定理とも言われます。
完全結晶のエントロピーは絶対零度()でゼロになる。
これはボルツマンの関係式 から導かれます。
絶対零度 において,分子は静止し位置が完全に決まります。そのため,微視的状態数 は1になります。このとき,エントロピー は0となります。
詳しく知りたい方は,統計力学を勉強してみてください。
エントロピーと情報理論
余談ですが,エントロピーは熱力学や統計力学だけではなく、情報理論という数学分野でも大きな役割を果たしています。
情報理論に関して興味がある方は,以下の記事を参考にしてください。
エントロピー増大の法則の身近な例
エントロピー増大の法則の身近な例
以上,エントロピーやエントロピー増大則の物理的な解釈を説明してきました。最後に身の回りにあるエントロピー増大則を紹介していきます。
エントロピー増大則とは不可逆過程を意味します。すなわち,自然に変化が起こる方向性がエントロピーが増大する方向と一致します。
例えば,
-
熱いコーヒーを置いておけば,自然に冷めていく。
-
コーヒーにミルクを入れれば,次第に混ざってコーヒーミルクになる。
-
暖房を入れると,暖かい空気が部屋中に充満する。
これらの現象は経験的にイメージできると思います。そして,逆事象の「冷めたコーヒーを置いておくと自然に熱くなる」,「混ぜたコーヒーミルクが勝手にコーヒーとミルクに分離する」などは起こりえません。
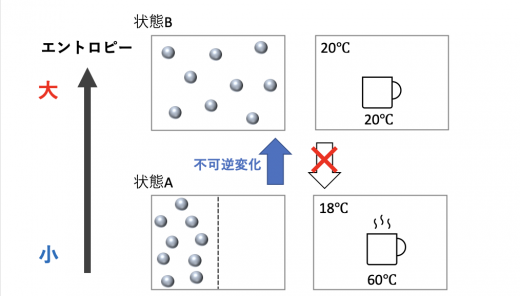
状態Aから状態Bにエントロピーが大きくなり,状態Aから状態Bへの方向性がエントロピー増大則となります。
「覆水盆に返らず」という故事成語があります。意味は「一度離縁した夫婦の仲は、元には戻らないことのたとえ。転じて、一度してしまったことは取り返しがつかないことのたとえ。」を指します。
この故事とエントロピー増大則とは通じるものを感じます。











