熱サイクル・熱機関・熱効率の定義と例
カルノーサイクルの熱効率 は, である。
熱力学第一法則とは違って,熱力学第二法則を理解するには少々準備が必要です。準備のための第一歩となる,熱サイクル,熱機関,熱効率とは何であるかの説明をします。また,熱サイクルの例をいくつか紹介して,カルノーサイクルについては熱効率も求めてみます。
熱サイクル・熱機関の定義
熱サイクル・熱機関の定義
熱サイクル,熱機関は,熱力学では以下のように定義されます:
任意の初期状態にある対象(これを作業物質と呼ぶ)を,吸熱や放熱を利用して状態変化(定圧変化,定積変化,断熱変化など)を施し,再び初期状態に戻すような一連の変化のことを,熱サイクルという。
熱サイクル,高温熱源,低温熱源を結びつけ,仕事を取り出す仕組みのことを熱機関という。
定義が長くなってしまいましたが,以下の文章を読みながらよく咀嚼して理解してほしいと思います。ちなみに,この記事では熱サイクルと熱機関は異なるものとして定義していますが,熱サイクルと熱機関はほぼ同じものです。言葉の定義の問題なので,混合して使われることもよくあります。
熱機関は,以下のような図を用いて描かれます。

は温度 の高温な熱源から熱サイクルが吸収する熱量, は温度 の低温な熱源に熱サイクルが放出する熱量です。吸収,放出が逆の場合は,マイナスの値を取れば解決します。例えば,高温な熱源に熱サイクルが熱を放出する場合は, をマイナスの値としてとればいいわけです。
は,熱サイクルがする正味の仕事です。つまり,サイクルが外にする仕事から,サイクルを動かすのに必要な仕事を引いたものです。
この記事に関連するQ&A
カルノーサイクル
カルノーサイクル
熱サイクルは,理論的に多数の例が考えられています。カルノーサイクルはその1例です。この後の理論的な展開のため,カルノーサイクルについては詳しく議論を進めます。
という4つの状態があり, という可逆変化をする熱サイクルを,カルノーサイクルといいます。 図を書けば以下のようになります:

における体積,圧力を と書くことにします。 についても同様な表記をすることにします。また, の温度を , の温度を とします。
では,作業物質として モルの理想気体をつかった場合の,カルノーサイクルの各状態遷移における内部エネルギー変化,仕事,熱の出入りについて定量的に考察してみます。途中で,「状態方程式」「熱力学第一法則」については特に断りなく用います。合わせて確認してください。
- の状態遷移
等温変化なので, です。また,正味の仕事については, と計算できます。熱力学第一法則より,吸収する熱量 は, と求めることができます。
- の状態遷移
断熱変化なので, が成立します。また, により,正味の仕事 は, と求めることができます。
- の状態遷移
の変化のときと同様に議論すれば,内部エネルギーの変化,正味の仕事,放熱する熱量は,それぞれ と計算することができます。
- の状態遷移
の変化のときと同様に議論すれば,放熱する熱量,内部エネルギーの変化,正味の仕事は,それぞれ と計算することができます。
逆カルノーサイクル
カルノーサイクルにおける状態遷移は可逆変化なので,理論的にはカルノーサイクルの真逆の変化をたどる熱サイクルを考えることができます。この熱サイクルを逆カルノーサイクルと呼ぶことがあります。

前節で計算したことの真逆なので,温度 の低温な熱源から熱サイクルが吸収する熱量を ,温度 の高温な熱源に熱サイクルが放出する熱量を ,サイクルがされる仕事を とすると, となります(もちろん前節のように真面目に計算しても良いです)。
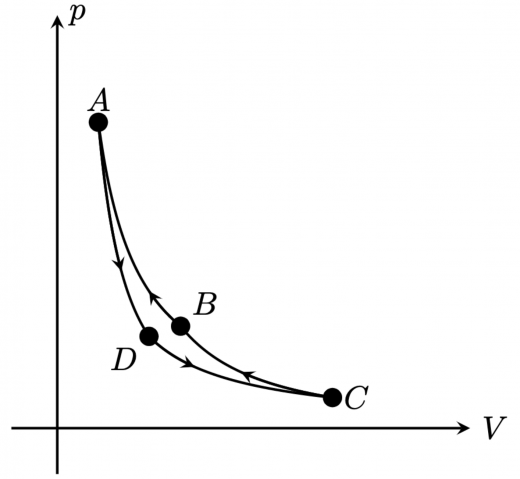
つまり,サイクルに仕事を与えることで,低温な熱浴から熱を奪い,さらに温度を下げることができるような装置ができる わけです。この機構は,クーラーや冷蔵庫の原理になっています。
オットーサイクル
カルノーサイクルの他にも,オットーサイクルと呼ばれる熱サイクルがあります。
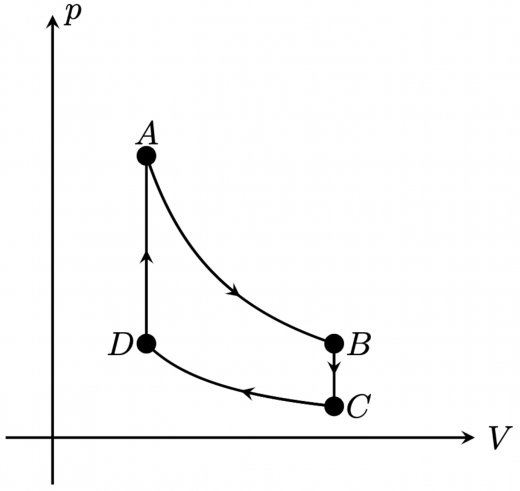
という4つの状態があり, という変化をする熱サイクルを,オットーサイクルといいます。p-V図を書けば以下のようになります:

スターリングサイクル
という4つの状態があり, という変化をする熱サイクルを,スターリングサイクルといいます。p-V図を書けば以下のようになります:
熱効率の定義
熱効率の定義
熱サイクルの性能を記述する量の代表例として,熱効率というものがあります。
熱サイクルの熱効率 を,正味の仕事 ,吸収する熱量 を用いて で定義する。
1サイクルで取り込んだ熱量のうち,どれくらいの割合を正味の仕事に変換することができるかを表すのが,熱サイクルの熱効率です。
例として,理想気体を作業物質としたカルノーサイクルの熱効率を求めてみます。
1サイクルにおける内部エネルギー変化は ですから, が成立します。これにより,
さて,断熱変化において,次の公式が成立します:
温度 ,体積 の状態 から,温度 ,体積 の状態 に断熱変化したとき,次のポアソンの式が成立する: ただし, は比熱比である。
この式の証明は別の記事→断熱変化におけるポアソンの式の導出で紹介しています(圧力 を状態方程式で消去すれば,記事の式と上の式は同じ式になります)。大学入試等では,ポアソンの式は一応範囲外であり,出題されるとしても既知の公式として問題文に与えられることが多いです。
ポアソンの式から,カルノーサイクルにおいて, が成立するので, が導けます。これを用いると, が成立します。
実は,この熱効率の値は,理想気体を作業物質としなくても成立する値であり,任意の熱機関はこの熱効率を超えることができない ことが,後に示されます。
この後の理論展開
この後の理論展開
これで熱力学第二法則を理解するための準備ができました。
この後,「トムソンの原理」「クラウジウスの原理」「オストヴァルトの原理」という概念が出てきます。これらは全て同値であることが証明できます。これらのうちの一つを原理として認めれば,それがあなたの熱力学における「熱力学第二法則」ということになります。
さらにこれらの原理から,「カルノーの定理」という定理を導くことができます。これは,「任意のサイクルの熱効率が,カルノーサイクルの熱効率を超えない」ということを主張する定理です。つまり,カルノーサイクル以上の熱効率を持つ熱サイクルを創りだすことは理論的にできないということです。
pV図の他に,ts図(ts線図)と呼ばれる,縦軸に温度,横軸にエントロピーをとった図も存在します。










