ボイル・シャルルの法則と状態方程式
理想気体において,次の関係が成り立ちます。ただし,圧力 ,温度 ,体積 ,物質量 とします。
ボイル・シャルルの法則
状態方程式
ここではボイル・シャルルの法則と状態方程式について解説します。
この記事に関連するQ&A
ボイル・シャルルの法則
ボイル・シャルルの法則
理想気体について,一般に次の法則が知られています。
ボイルの法則:
が一定のとき,
シャルルの法則:
が一定のとき,
上記2式をまとめてボイル・シャルルの法則といいます。
ボイルの法則

ボイルの法則は,気体を等温変化させた時,その圧力と体積が反比例することを示したものです。
以下のようなシリンダーに閉じ込められた気体分子を考えると,直感的に理解しやすいでしょう。温度一定の下で,シリンダーにかける圧力を2倍,3倍と大きくしていくと、体積が1/2倍,1/3倍と小さくなっていきます。

シャルルの法則
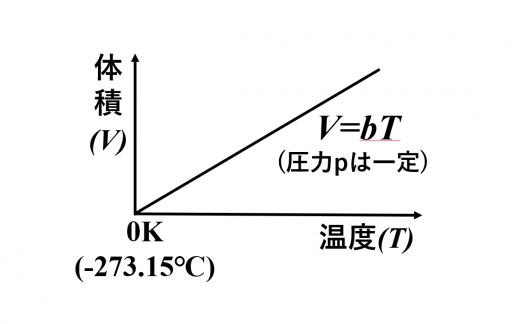
シャルルの法則は,気体を定圧変化させた時,その体積と温度が比例することを示したものです。
ここでもシリンダーに閉じ込められた気体分子をイメージしてみましょう。圧力一定のもとで,気体分子の温度を2倍,3倍とすると,体積も2倍,3倍となります。温めると体積が大きくなるのは,気体分子の熱運動が大きくなるからです。

なお、この時の「温度」とは絶対温度()のことです。セルシウス温度(C)ではないので注意しましょう。(気温が10Cから20Cになっただけで体積が2倍になってしまっては,明らかに日常生活に支障をきたしてしまいますね。)
ボイル・シャルルの法則の導出
ボイルの法則とシャルルの法則から,ボイル・シャルルの法則を導出します。
圧力 ,温度 ,体積 の理想気体の状態変化を考える。
この気体を体積 ,温度 に定圧変化させると,シャルルの法則より,
続けて,この気体を圧力 ,体積 に等温変化させると,
2式を整理して,
整理して,
ここで,,等温変化後の温度を として より,
したがって,
状態方程式
状態方程式
ボイル・シャルルの法則 において, は に比例することが分かりました。つまり,
これを整理して,理想気体の状態方程式が得られます。
ここで を気体定数といい,
なお,実在気体において近似的に状態方程式を利用する際は,質量を ,気体の分子量を として,と表すこともあります。
状態方程式から導かれる数値や性質は多いです。
例えば,標準状態(1気圧 の状態)での理想気体 あたりの体積は,状態方程式より
他にも,断熱変化におけるポアソンの式なども,状態方程式より導出することができます。
実在気体の理想気体とのズレ
実在気体の理想気体とのズレ
ボイルの法則もシャルルの法則も,理想気体においてのみ成り立ちます。当然,これら2式をまとめたボイル・シャルルの法則も,そこから導かれる状態方程式も同様です。
理想気体とは体積が で,分子間力が働かない気体のことを指します。理想気体は現実には存在しません。
現実に存在する気体のことを,理想気体に対して実在気体と呼びます。実在気体においては、ボイル・シャルルの法則や状態方程式は成り立ちませんが,気体が理想気体に近い振る舞いをする条件下では, の値が1に近づきます(理想気体では )。

実在気体において, の値が1より小さい時は,主に分子間力が原因です。分子間力により実在気体分子同士が引き合うことで,体積 が小さくなるからです。
の値が1より大きい時は,主に分子の体積が原因です。高圧条件下では実在気体の分子体積が無視できなくなり,体積 が大きくなるからです。
なお,高温低圧下においては,分子間力や実在気体の体積の影響が小さくなるので, の値が1に近づきます。
ボイル・シャルルの法則と状態方程式は,化学でも大活躍の法則ですね。









